Auteur van de tweede wet van de thermodynamica. Entropie, tweede wet van de thermodynamica
De eerste wet van de thermodynamica is de wet van behoud van energie zoals toegepast op thermodynamische processen: energie verdwijnt niet in het niets en ontstaat niet uit het niets, maar gaat alleen in gelijkwaardige hoeveelheden van het ene type naar het andere over. Een voorbeeld hiervan is de overdracht van warmte (thermische energie) omgezet in mechanische energie, en omgekeerd.
Als kg gas dat volume V (m 3) inneemt bij temperatuur T wordt opgeteld bij M at constante druk een bepaalde hoeveelheid warmte dQ, dan zal als resultaat de gastemperatuur stijgen met dT en het volume met dV. Een temperatuurstijging gaat gepaard met een toename van de kinetische energie van moleculaire beweging dK.
Een toename van het volume gaat gepaard met een toename van de afstand tussen moleculen en, als gevolg daarvan, een afname van de potentiële energie dH van interactie daartussen. Bovendien werkt het gas, door het volume ervan te vergroten, dA om externe krachten te overwinnen.
Als er, naast de aangegeven, geen andere processen plaatsvinden in de werkvloeistof, kunnen we op basis van de wet van behoud van energie schrijven:
dQ = dK + dH + dA.
De som dK + dH vertegenwoordigt de verandering interne energie dU van de moleculen van het systeem als gevolg van de toevoer van warmte.
Dan kan de energiebesparingsformule voor een thermodynamisch proces worden geschreven als:
dQ = dU + dA of dQ = dU + pdV.
Deze vergelijking is wiskundige uitdrukking eerste wet van de thermodynamica: de hoeveelheid warmte dQ die aan het gassysteem wordt geleverd, wordt besteed aan het veranderen van de interne energie dU en het uitvoeren van extern werk dA.
Conventioneel wordt aangenomen dat wanneer dQ > 0 warmte wordt overgedragen naar de werkvloeistof, en wanneer dQ< 0 теплота отнимается от тела. При dA >0 Het systeem werkt (gas zet uit) en bij dA< 0 работа совершается над системой (газ сжимается) .
Voor Ideaal gas, tussen de moleculen waarvan er geen interactie is, wordt de verandering in interne energie dU volledig bepaald door de verandering in de kinetische bewegingsenergie (dat wil zeggen het verhogen van de snelheid van moleculen), en de verandering in volume karakteriseert het werk van het gas om externe krachten te overwinnen.
De eerste wet van de thermodynamica heeft een andere formulering: de energie van een geïsoleerd thermodynamisch systeem blijft onveranderd, ongeacht welke processen daarin plaatsvinden.
Het is onmogelijk om een perpetuum mobile van de eerste soort te bouwen, dat wil zeggen een periodiek werkende machine die werk zou doen zonder energie te verbruiken.
Tweede wet van de thermodynamica
De eerste wet van de thermodynamica beschrijft de kwantitatieve relaties tussen de parameters van een thermodynamisch systeem die plaatsvinden bij de processen van het omzetten van thermische energie in mechanische energie en vice versa, maar stelt niet de omstandigheden vast waaronder deze processen mogelijk zijn. Deze voorwaarden die nodig zijn voor de transformatie van het ene type energie in het andere worden onthuld door de tweede wet van de thermodynamica.
Er zijn verschillende formuleringen van deze wet, en elk ervan heeft dezelfde semantische inhoud. Hier zijn de meest geciteerde formuleringen van de tweede wet van de thermodynamica.
1. Warmte omzetten in mechanisch werk het is noodzakelijk om een warmtebron en een koelkast te hebben waarvan de temperatuur lager is dan de temperatuur van de bron, d.w.z. er is een temperatuurverschil noodzakelijk.
2. Het is onmogelijk om een warmtemotor te implementeren, waarvan het enige resultaat de transformatie van de warmte van welk lichaam dan ook in werk zou zijn, zonder dat een deel van de warmte wordt overgedragen naar andere lichamen.
Uit deze formulering kunnen we concluderen dat het onmogelijk is een perpetuum mobile te bouwen die werkt dankzij slechts één warmtebron, aangezien geen enkele, zelfs de meest kolossale warmtebron in de vorm van een materieel lichaam niet in staat is meer energie te leveren. thermische energie dan de enthalpie toelaat (deel van de totale energie van een lichaam dat kan worden omgezet in warmte door het lichaam af te koelen tot het absolute nulpunt).
3. Warmte kan niet op zichzelf van een minder verwarmd lichaam naar een meer verwarmd lichaam gaan zonder dat er extern werk aan wordt besteed.
Zoals u kunt zien, is de tweede wet van de thermodynamica niet gebaseerd op de inhoud van formules, maar beschrijft zij alleen de omstandigheden waaronder bepaalde thermodynamische verschijnselen en processen mogelijk zijn, waarmee in feite de algemene wet van behoud van energie wordt bevestigd.
Introductie_3
Algemene kenmerken en formulering van de tweede wet van de thermodynamica 4
Het concept van entropie_ 8
Conclusie_ 10
Referenties_ 11
Invoering
Momenteel worden thermische energie en thermische installaties op grote schaal gebruikt in verschillende industrieën nationale economie. In industriële ondernemingen vormen ze het belangrijkste onderdeel van technologische apparatuur.
Wetenschap die methoden bestudeert voor het gebruik van brandstofenergie, de wetten van processen die de toestand van materie veranderen, de werkingsprincipes van verschillende machines en apparaten, energie en technologische installaties, heet thermische techniek. Theoretische grondslagen Thermische engineering is thermodynamica en warmteoverdrachtstheorie.
De thermodynamica is gebaseerd op fundamentele wetten (principes), die een generalisatie zijn van observaties van processen die in de natuur plaatsvinden, ongeacht de specifieke eigenschappen van lichamen. Dit verklaart de universaliteit van patronen en relaties daartussen fysieke hoeveelheden verkregen uit thermodynamisch onderzoek.
De eerste wet van de thermodynamica karakteriseert en beschrijft de processen van energietransformatie vanuit de kwantitatieve kant en biedt alles wat nodig is voor het opstellen van de energiebalans van elke installatie of proces.
De tweede wet van de thermodynamica, de belangrijkste natuurwet, bepaalt de richting waarin thermodynamische processen verlopen, stelt vast mogelijke grenzen de omzetting van warmte in arbeid in circulaire processen stelt ons in staat een strikte definitie te geven van begrippen als entropie, temperatuur, enz. In dit opzicht vormt de tweede wet van de thermodynamica een aanzienlijke aanvulling op de eerste.
Het principe van de onbereikbaarheid van het absolute nulpunt wordt aanvaard als de derde wet van de thermodynamica.
De theorie van warmteoverdracht bestudeert de patronen van warmteoverdracht van het ene gebied in de ruimte naar het andere. Warmteoverdrachtsprocessen zijn processen van uitwisseling van interne energie tussen de elementen van het beschouwde systeem in de vorm van warmte.
Algemene kenmerken en formulering van de tweede wet van de thermodynamica
Natuurlijke processen zijn altijd gericht op het bereiken van een evenwichtstoestand (mechanisch, thermisch of anderszins) door het systeem. Dit fenomeen wordt weerspiegeld door de tweede wet van de thermodynamica, die ook van groot belang is voor het analyseren van de werking van thermische energiemachines. In overeenstemming met deze wet kan warmte bijvoorbeeld alleen spontaan worden overgedragen van een lichaam met een hogere temperatuur naar een lichaam met een lagere temperatuur. Om het omgekeerde proces uit te voeren, moet er wat werk worden besteed. In dit opzicht kan de tweede wet van de thermodynamica als volgt worden geformuleerd: een proces waarbij warmte spontaan van koudere lichamen naar warmere lichamen zou worden overgedragen, is onmogelijk (postulaat van Clausius, 1850).
De tweede wet van de thermodynamica bepaalt ook de omstandigheden waaronder warmte zo lang als gewenst in arbeid kan worden omgezet. In elk open thermodynamisch proces wordt, naarmate het volume toeneemt, positief werk verricht:
 ,
,
waar ik het laatste werk is,
v 1 en v 2 zijn respectievelijk het initiële en het uiteindelijke specifieke volume;
maar het expansieproces kan niet oneindig doorgaan, daarom is de mogelijkheid om warmte in arbeid om te zetten beperkt.
Het continu omzetten van warmte in arbeid vindt alleen plaats in een circulair proces of cyclus.
Elk elementair proces dat deel uitmaakt van de cyclus wordt uitgevoerd bij de toevoer of afvoer van warmte dQ, gaat gepaard met de voltooiing of uitgave van werk, een toename of afname van de interne energie, maar altijd wanneer aan de voorwaarde is voldaan dQ= dU+ dL En dq= du+ dl, waaruit blijkt dat zonder warmtetoevoer ( dq=0) extern werk kan alleen worden bereikt dankzij de interne energie van het systeem, en de toevoer van warmte aan een thermodynamisch systeem wordt bepaald door het thermodynamische proces. Gesloten lusintegratie geeft:
Hier Q C En L C- respectievelijk de warmte die in de cyclus in arbeid wordt omgezet en de arbeid die door de arbeidsvloeistof wordt verricht, wat het verschil is | L1 | - |L2| positieve en negatieve werken van elementaire processen van de cyclus.
De elementaire hoeveelheid warmte kan als geleverd worden beschouwd ( dQ>0) en omgeleid ( dQ<0) uit de werkvloeistof. De som van de in de cyclus geleverde warmte |Q 1 |, en de som van de afgevoerde warmte |Q 2 |. Vandaar,
L C =Q C =|V1 | - |V2 |.
De toevoer van warmtehoeveelheid Q1 aan de werkvloeistof is mogelijk in aanwezigheid van een externe bron met een temperatuur hoger dan de temperatuur van de werkvloeistof. Deze warmtebron wordt heet genoemd. Het verwijderen van de hoeveelheid warmte Q2 uit het werkfluïdum is ook mogelijk in aanwezigheid van een externe warmtebron, maar met een temperatuur lager dan de temperatuur van het werkfluïdum. Zo’n warmtebron heet koud. Om een cyclus te voltooien, zijn er dus twee warmtebronnen nodig: één met een hoge temperatuur, de andere met een lage temperatuur. In dit geval kan niet de gehele verbruikte hoeveelheid warmte Q1 worden omgezet in arbeid, omdat de hoeveelheid warmte Q2 wordt overgedragen naar een koudebron.
De bedrijfsomstandigheden van een warmtemotor zijn als volgt:
De behoefte aan twee warmtebronnen (warm en koud);
Cyclische werking van de motor;
Overdracht van een deel van de hoeveelheid warmte die wordt ontvangen van een warme bron naar een koude bron, zonder deze in arbeid om te zetten.
In dit opzicht kan de tweede wet van de thermodynamica nog een aantal andere formuleringen krijgen:
- overdracht van warmte van een koude bron naar een warme bron is onmogelijk zonder de kosten van werk;
- het is onmogelijk om een periodiek werkende machine te bouwen die werk verricht en dienovereenkomstig het thermische reservoir afkoelt;
- de natuur streeft naar een overgang van minder waarschijnlijke toestanden naar meer waarschijnlijke toestanden.
Benadrukt moet worden dat de tweede wet van de thermodynamica (net als de eerste) is geformuleerd op basis van ervaring.
In zijn meest algemene vorm kan de tweede wet van de thermodynamica als volgt worden geformuleerd: elk echt spontaan proces is onomkeerbaar. Alle andere formuleringen van de tweede wet zijn speciale gevallen van de meest algemene formulering.
W. Thomson (Lord Kelvin) stelde in 1851 de volgende formulering voor: Het is onmogelijk om, met behulp van een levenloos materieel middel, mechanische arbeid uit welke massa materie dan ook te verkrijgen door deze af te koelen tot onder de temperatuur van het koudste omringende object.
M. Planck stelde een formulering voor die duidelijker was dan die van Thomson: Het is onmogelijk om een periodiek werkende machine te bouwen, waarvan de hele werking zou worden gereduceerd tot het concept van een bepaalde belasting en koeling van een warmtebron. Een periodiek werkende machine moet worden opgevat als een motor die continu (in een cyclisch proces) warmte omzet in arbeid. Als het mogelijk zou zijn om een warmtemotor te bouwen die eenvoudigweg warmte uit een bepaalde bron haalt en deze continu (cyclisch) omzet in werk, dan zou dit in tegenspraak zijn met het standpunt dat een systeem alleen arbeid kan produceren als er geen evenwicht is. (in het bijzonder met betrekking tot een warmtemotor - wanneer er een temperatuurverschil is tussen warme en koude bronnen in het systeem).
Als er geen beperkingen zouden gelden opgelegd door de tweede wet van de thermodynamica, zou dit betekenen dat het mogelijk zou zijn een warmtemotor te bouwen met slechts één warmtebron. Zo'n motor zou kunnen werken door bijvoorbeeld water in de oceaan te koelen. Dit proces zou kunnen doorgaan totdat alle interne energie van de oceaan in arbeid was omgezet. Een warmtemotor die op deze manier zou werken, werd toepasselijk genoemd door V.F perpetuum mobile van de tweede soort (in tegenstelling tot een perpetuum mobile van de eerste soort, die in strijd is met de wet van behoud van energie). In overeenstemming met het bovenstaande kan de formulering van de tweede hoofdwet van de thermodynamica, gegeven door Planck, als volgt worden gewijzigd: de implementatie van een perpetuum mobile van de tweede soort is onmogelijk.
Opgemerkt moet worden dat het bestaan van een eeuwigdurende bewegingsmachine van de tweede soort niet in tegenspraak is met de eerste wet van de thermodynamica; in feite zou in deze motor arbeid niet uit het niets worden geproduceerd, maar uit de interne energie die in de warmtebron zit, zodat vanuit de kwantitatieve kant het proces van het verkrijgen van arbeid uit warmte in dit geval niet onmogelijk zou zijn. Het bestaan van een dergelijke motor is echter onmogelijk vanuit het oogpunt van de kwalitatieve kant van het proces van warmteoverdracht tussen lichamen.
Het concept van entropie
De discrepantie tussen de transformatie van warmte in werk en werk in warmte leidt tot een eenzijdige richting van echte processen in de natuur, die de fysieke betekenis weerspiegelt van de tweede wet van de thermodynamica in de wet over het bestaan en de toename van echte processen van een bepaalde functie genoemd entropie , definiëren maatstaf voor de energieafschrijving.
Vaak wordt de tweede wet van de thermodynamica gepresenteerd als een verenigd principe van het bestaan en de toename van entropie.
Een van de basiswetten van de natuurkunde is de wet van niet-afnemende entropie in een geïsoleerd systeem.
Voor een systeem met constante temperatuur is er een bepaalde toestandsfunctie S - entropie, die zo is gedefinieerd dat
1. Een adiabatische overgang van evenwichtstoestand A naar evenwichtstoestand B is alleen mogelijk wanneer:
2. De toename van de entropie in een langzaam quasi-statisch proces is gelijk aan
Waar T de temperatuur is.
De bovenstaande formulering is zeer formeel. Er zijn veel alternatieve formuleringen van de tweede wet van de thermodynamica. Planck stelde bijvoorbeeld de volgende formulering voor:
Het is onmogelijk om een machine te bouwen die fietst, een warmtebron koelt of lasten optilt zonder dat dit veroorzaakt echter geen veranderingen in natuur.
Constantijn Carathéodory gaf een axiomatisch strikte formulering
In de buurt van toestand 1 bestaan dergelijke toestanden 2; adiabatische overgangen van toestand 1 naar toestand 2 zijn onmogelijk.
Boltzmann formuleerde de tweede wet van de thermodynamica vanuit het oogpunt van de statistische natuurkunde:
De natuur heeft de neiging zich te verplaatsen van toestanden met een lagere waarschijnlijkheid van realisatie naar toestanden met een hogere waarschijnlijkheid van realisatie.
Dergelijke formuleringen zijn gebruikelijk.
Het is onmogelijk om een eeuwige beweger van een ander soort te zijn.
Het is onmogelijk om warmte van een koud lichaam naar een warm lichaam over te dragen zonder energie te verbruiken.
Elk systeem heeft de neiging om van orde naar wanorde te gaan.
De tweede wet van de thermodynamica werd halverwege de 19e eeuw geformuleerd, in een tijd waarin de theoretische basis voor het ontwerp en de constructie van warmtemotoren werd gecreëerd. De experimenten van Mayer en Joule stelden de gelijkwaardigheid vast tussen thermische en mechanische energieën (de eerste wet van de thermodynamica). De vraag rees over de efficiëntie van warmtemotoren. Experimentele studies hebben aangetoond dat er noodzakelijkerwijs wat warmte verloren gaat tijdens de werking van welke machine dan ook.
In de jaren vijftig en zestig van de negentiende eeuw ontwikkelde Clausius het concept van entropie in een aantal publicaties. In 1865 koos hij uiteindelijk een naam voor het nieuwe concept. Deze publicaties bewezen ook dat warmte niet volledig kan worden omgezet in nuttig werk, waarmee de tweede wet van de thermodynamica werd geformuleerd.
Boltzmann gaf een statistische interpretatie van de tweede wet van de thermodynamica en introduceerde een nieuwe definitie voor entropie, die gebaseerd was op microscopisch kleine atomistische concepten.
De statistische natuurkunde introduceert een nieuwe definitie van entropie, die op het eerste gezicht heel anders is dan de definitie van thermodynamica. Het wordt gegeven door de Boltzmann-formule:
Waar? - het aantal microscopische toestanden dat overeenkomt met een gegeven macroscopische toestand, k B- Boltzmann-constante.
Uit de statistische definitie van entropie blijkt duidelijk dat een toename van de entropie overeenkomt met een overgang naar een macroscopische toestand die wordt gekenmerkt door de hoogste waarde van microscopische toestanden.
Als de begintoestand van een thermodynamisch systeem niet in evenwicht is, beweegt het na verloop van tijd naar een evenwichtstoestand, waardoor de entropie toeneemt. Dit proces vindt slechts in één richting plaats. Het omgekeerde proces – de overgang van een evenwichtstoestand naar een aanvankelijke niet-evenwichtstoestand – wordt niet gerealiseerd. Dat wil zeggen: de stroom van de tijd krijgt richting.
De wetten van de natuurkunde die de microscopische wereld beschrijven, zijn onveranderlijk onder de vervanging van t door -t. Deze bewering geldt zowel voor de wetten van de klassieke mechanica als voor de wetten van de kwantummechanica. In de microscopische wereld werken conservatieve krachten; er is geen wrijving, wat de dissipatie van energie is, d.w.z. de transformatie van andere soorten energie in de energie van thermische beweging, en dit houdt op zijn beurt verband met de wet van niet-afnemende entropie.
Stel je bijvoorbeeld een gas voor in een reservoir dat in een groter reservoir is geplaatst. Als je de klep van de kleinere tank opent, zal het gas na enige tijd de grotere tank vullen, zodat de dichtheid ervan gelijk wordt. Volgens de wetten van de microscopische wereld vindt er ook een omgekeerd proces plaats, waarbij gas uit een groter reservoir in een kleinere container wordt opgevangen. Maar in de macroscopische wereld gebeurt dit nooit.
Als de entropie van elk geïsoleerd systeem met de tijd alleen maar toeneemt, en het heelal een geïsoleerd systeem is, zal de entropie op een dag een maximum bereiken, waarna eventuele veranderingen daarin onmogelijk zullen worden.
Dergelijke overwegingen die verschenen na de oprichting van de tweede wet van de thermodynamica, genoemd hitte dood. Over deze hypothese werd in de 19e eeuw veel gedebatteerd.
Elk proces in de wereld leidt tot de dissipatie van een deel van de energie en de omzetting ervan in warmte, wat tot grotere wanorde leidt. Natuurlijk is ons heelal nog vrij jong. Thermonucleaire processen in sterren leiden bijvoorbeeld tot een gestage stroom van energie naar de aarde. De aarde is en zal nog lange tijd een open systeem blijven, dat energie ontvangt uit verschillende bronnen: van de zon, van radioactieve vervalprocessen in de kern, etc. In open systemen kan de entropie afnemen, wat leidt tot het ontstaan van een verscheidenheid aan comfortabele structuren.
De basis van de thermodynamica zijn de fundamentele natuurwetten, geformuleerd op basis van een generalisatie van de resultaten van vele experimentele studies en ontdekkingen. Van deze wetten, aanvaard als axioma's; Alle belangrijkste gevolgen met betrekking tot verschillende thermodynamische systemen, die de principes en/of wetten van de thermodynamica worden genoemd, werden op een logische manier verkregen.
1.2.1. Eerste wet van de thermodynamica
Absoluut in zijn essentie, een van de meest algemene natuurwetten - wet van behoud en transformatie van energie. Volgens deze wet blijft de energie van een gesloten systeem onveranderd tijdens alle processen die in het systeem plaatsvinden. In dit geval kan energie alleen van de ene vorm naar de andere worden getransformeerd.
Eerst de wet van de thermodynamica is een speciaal geval van deze algemene wet en vertegenwoordigt de toepassing ervan op processen in thermodynamische systemen. Het stelt de mogelijkheid vast om verschillende vormen van energie in elkaar te transformeren en bepaalt in welke kwantitatieve verhoudingen deze onderlinge transformaties worden uitgevoerd.
Een verandering in de energie van een willekeurig, niet-geïsoleerd systeem kan over het algemeen alleen plaatsvinden als gevolg van twee vormen van energie-uitwisseling: warmte en arbeid:
∆E = Q – L , (1.12)
waar ∆ E– verandering in de energie van het systeem;
Q– warmte geleverd aan het systeem;
L– werkzaamheden aan het systeem.
Volgens vergelijking (1.12) is een verandering in de energie van een thermodynamisch systeem mogelijk als gevolg van de warmte die aan het systeem wordt geleverd en de arbeid die aan het systeem wordt verricht.
Vergelijking (1.12) is een algemene analytische uitdrukking van de eerste wet van de thermodynamica. Laten we het uitdrukken via de parameters van de systeemstatus. Energieverandering ∆ E we verkrijgen uit uitdrukking (1.7):
∆E = ∆ I + M ( ).
Voor een thermodynamisch systeem waarin het verschil in kinetische energie kan worden verwaarloosd, zal de verandering in de energie van het systeem gelijk zijn aan de verandering in enthalpie, dat wil zeggen ∆ E = ∆ I. Vervolgens verkrijgen we, rekening houdend met de uitdrukkingen (1.11) en (1.12), de vergelijking van de eerste wet van de thermodynamica in de vorm:
Q = ∆I + L die (1.13)
De warmte die aan het systeem wordt geleverd, gaat de enthalpie van het systeem veranderen en technisch werk aan het systeem uitvoeren.
Laten we in vergelijking (1.13) de verandering in enthalpie ∆ vervangen I verandering in interne energie D U en met behulp van uitdrukking (1.6) krijgen we:
Q = ∆ U+ L ext.
(1.14)
Vergelijkingen (1.13) en (1.14) vertegenwoordigen de integrale vorm van het schrijven van de eerste wet van de thermodynamica. I Uit uitdrukking (1.13) volgt dat technisch werk kan worden uitgevoerd door een thermodynamisch systeem door de enthalpie en de warmte-inbreng te verminderen. Als het proces circulair is, dan is ∆
= 0, dus in constant werkende machines (waarin de processen van toestandsverandering circulair zijn), om technisch werk te verkrijgen, is een noodzakelijke voorwaarde de toevoer van warmte.
Een soortgelijke redenering kan worden uitgevoerd met behulp van vergelijking (1.14). Een thermodynamisch systeem kan alleen expansiewerk uitvoeren door de interne energie te verminderen of door warmte toe te voegen. Als als gevolg van het proces de interne energie van het systeem niet verandert (de temperatuur in het systeem verandert bijvoorbeeld niet), dan wordt alle warmte die het systeem ontvangt van omgeving
Q = L, gaat het werk doen:
ext.
Met deze uitdrukking kunnen we de volgende formuleringen geven van de eerste wet van de thermodynamica.
Wanneer de interne energie van het systeem constant blijft, zijn warmte en arbeid gelijkwaardig.
Een perpetuum mobile van de eerste soort is onmogelijk.
Er werd aangenomen dat een perpetuum mobile van de eerste soort alleen maar werk aan het milieu zou mogen doen, zonder daar iets van te ontvangen.
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: = ∆ Q + i die ; (1.15)
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: = ∆ l + i u (1.16)
race
Met behulp van uitdrukkingen (1.9) en (1.11) schrijven we de resulterende vergelijkingen in differentiële vorm: = dq - di (1.17)
Met behulp van uitdrukkingen (1.9) en (1.11) schrijven we de resulterende vergelijkingen in differentiële vorm:= vdp + du (1.18)
Vergelijkingen (1.17) en (1.18) zijn een soort wiskundige weergave van de eerste wet van de thermodynamica in differentiële vorm.
De betekenis van de eerste wet:
ten eerste vormt het het ontwerpprincipe van thermische energiecentrales en -systemen;
ten tweede verklaart het de fysieke essentie van de processen die plaatsvinden in warmtemotoren;
ten derde wordt het gebruikt bij berekeningen van thermodynamische processen en maakt het mogelijk de energiebalans van warmtemotoren te schatten.
1.2.2. Tweede wet van de thermodynamica
De eerste wet van de thermodynamica, die een speciaal geval is van de wet van behoud en transformatie van energie, houdt alleen rekening met de kwantitatieve kant ervan, die erin bestaat dat bij een bekende verandering in de energie van het systeem de relatie tussen warmte en arbeid gelijk is. strikt bepaald. Deze wet bepaalt niet de richting en de volledigheid van de overdracht van energie tussen lichamen, bepaalt niet de omstandigheden waaronder de transformatie van warmte in arbeid mogelijk is, en maakt geen onderscheid tussen hun directe en omgekeerde transformaties. Als we alleen uitgaan van de eerste wet van de thermodynamica, is het legitiem om aan te nemen dat elk denkbaar proces dat niet in tegenspraak is met de wet van behoud van energie fundamenteel mogelijk is en in de natuur zou kunnen plaatsvinden. Het antwoord op de gestelde vragen wordt gegeven door seconde de wet van de thermodynamica, een reeks bepalingen die experimentele gegevens over de kwalitatieve kant van de wet van behoud en transformatie van energie generaliseren.
De verscheidenheid aan kenmerken van de wederzijdse transformatie van warmte en arbeid, evenals de verschillende aspecten waarin deze transformaties worden beschouwd, verklaren de aanwezigheid van verschillende, in wezen gelijkwaardige formuleringen van de tweede wet van de thermodynamica.
De belangrijkste bepalingen van deze wet zijn geformuleerd door de Franse ingenieur S. Carnot (1824). Carnot kwam tot de conclusie dat er twee warmtebronnen met verschillende temperaturen nodig zijn om warmte in arbeid om te zetten. De naam ‘Tweede wet van de thermodynamica’ en historisch gezien de eerste formulering ervan (1850) zijn van de Duitse natuurkundige R. Clausius:
“Warmte kan alleen vanzelf worden overgedragen van een warm lichaam naar een koud lichaam; voor de omgekeerde transitie is het noodzakelijk om werk te besteden”,
Uit deze stelling volgt dat voor de overdracht van warmte van een lichaam met een lagere temperatuur naar een lichaam met een hogere temperatuur het noodzakelijk is om in een of andere vorm energie uit een externe bron te leveren, bijvoorbeeld in de vorm van werk. Daarentegen gaat de warmte van een lichaam met een hogere temperatuur spontaan, zonder de besteding van enige vorm van energie, over naar lichamen met een lagere temperatuur. Dit betekent met name dat warmteoverdracht bij een eindig temperatuurverschil een strikt eenzijdig, onomkeerbaar proces is, en gericht is op lichamen met een lagere temperatuur.
De tweede wet van de thermodynamica ligt ten grondslag aan de theorie van warmtemotoren. Een warmtemotor is een continu werkend apparaat, met als resultaat de omzetting van warmte in arbeid. Om een warmtemotor te creëren die continu werk produceert, is het dus in de eerste plaats noodzakelijk om een lichaam te hebben dat energie levert in de vorm van warmte. Laten we het de warmtebron noemen .
Er moet een ander lichaam zijn dat van het eerste ontvangt
uh  energie in de vorm van warmte, maar geeft deze terug in de vorm van arbeid. Dit is het zogenaamde werk
h e t e l
O. Zijn rol wordt gespeeld door een elastisch medium (gas, stoom).
De toevoer van warmte en de omzetting ervan in arbeid gaat gepaard met een verandering in de toestand van de arbeidsvloeistof.
energie in de vorm van warmte, maar geeft deze terug in de vorm van arbeid. Dit is het zogenaamde werk
h e t e l
O. Zijn rol wordt gespeeld door een elastisch medium (gas, stoom).
De toevoer van warmte en de omzetting ervan in arbeid gaat gepaard met een verandering in de toestand van de arbeidsvloeistof.
In afb. 1.6 laten we deze verandering zien in de voorwaardelijke curve van proces 1-a-2. Hier veranderen de toestandsparameters en vooral het volume van de werkvloeistof, wat leidt tot expansiewerkzaamheden. Om continu werk te verkrijgen, moet de werkvloeistof via het 2-b-1-proces in de oorspronkelijke staat worden teruggebracht. Dus
Rijst. 1.6 Voor de continue omzetting van warmte in arbeid moet deze gesloten cirkel voortdurend worden uitgevoerd
c e s s of c ik l. Een circulair proces, of cyclus, is een reeks thermodynamische processen, waardoor de werkvloeistof terugkeert naar de oorspronkelijke staat.
Als resultaat van de op deze manier uitgevoerde cyclus 1-a-2-b-1, getoond in Fig. 1.6, slechts een deel van de hitte Q 1 ontvangen door de werkvloeistof van de warmtebron wordt omgezet in arbeid, terwijl het andere deel van deze warmte Q 2 moet aan het koellichaam worden gegeven.
Begin van het formulier
In het beschouwde schema van een continu werkende warmtemotor is dezelfde werkvloeistof voortdurend betrokken in een circulair proces. In de cycli van echte motoren wordt de werkstof periodiek vernieuwd, d.w.z. vervangen door een gelijke hoeveelheid “verse” substantie. Vanuit thermodynamisch oogpunt kan het vervangen van een werkstof worden beschouwd als het terugbrengen van de werkvloeistof naar de oorspronkelijke staat.
Einde formulier
Voor de continue omzetting van warmte in arbeid heb je dus nodig: een warmtebron; een werkvloeistof en een warmteafvoer met een lagere temperatuur dan de warmtebron. Het afvoeren van een deel van de warmte naar het koellichaam is een voorwaarde voor het functioneren van warmtemotoren. Deze voorwaarde wordt vermeld in de volgende formuleringen van de tweede wet van de thermodynamica:
“Het is onmogelijk om een periodiek werkende machine te bouwen die niets anders doet dan werken en de warmtebron koelen” (W. Thomson).
“Alle natuurlijke processen zijn een overgang van minder waarschijnlijke naar meer waarschijnlijke toestanden” (L. Boltzmann).
“De implementatie van een perpetuum mobile van de tweede soort is onmogelijk”
(W.Oswald).
Met een ‘eeuwigdurende’ motor van de tweede soort bedoelen we een warmtemotor die continu werk kan verrichten met slechts één warmtebron. Uit de tweede wet van de thermodynamica volgt dat, ongeacht hoeveel thermische energie een systeem bezit, deze energie niet in arbeid kan worden omgezet als de temperaturen van de lichamen van het systeem gelijk zijn. Om deze reden bleken de pogingen van duizenden uitvinders van ‘perpetuum mobile’-machines om expansiewerk uit te voeren vruchteloos.
 De verdeling van de energie ontvangen van een warmtebron in warmtemotoren wordt schematisch weergegeven in figuur 2. 1.7. De nuttige arbeid die door 1 kg werkvloeistofmassa per cyclus wordt verricht, is gelijk aan het verschil in de expansiearbeid i expansie en compressie i szh, d.w.z.
De verdeling van de energie ontvangen van een warmtebron in warmtemotoren wordt schematisch weergegeven in figuur 2. 1.7. De nuttige arbeid die door 1 kg werkvloeistofmassa per cyclus wordt verricht, is gelijk aan het verschil in de expansiearbeid i expansie en compressie i szh, d.w.z.
i ts = i verlengd - i zz. (1.19)
Kwantitatieve relatie tussen warmte en arbeid voor 1 kg werkvloeistof in de processen van uitzetting 1-a-2 en compressie 2-b-1
(zie figuur 1.6) gebaseerd op de eerste wet van de thermodynamica schrijven we de volgende vergelijkingen:
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: 1 = ∆ l 1- A 2 + i verlengd En Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: 2 = ∆ l 2-b-1 + i C En ,
waarbij q 1 de hoeveelheid warmte is die door de warmtebron aan 1 kg werkvloeistof wordt geleverd;
q 2 – hoeveelheid warmte die wordt verwijderd
1 kg werkvloeistof naar het koellichaam;
∆u 1- a -2 en ∆u 2-b-1 – verandering in intern
energie van 1 kg werkvloeistof in processen Fig. 1.7
1-a-2 en 2-b-1, respectievelijk.
Trek de tweede vergelijking af van de eerste en krijg:
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: 1 – Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: 2 = ∆ l 1-a-2-b-1 + (i verlengd – i zz ).
Omdat de werkvloeistof terugkeert naar de oorspronkelijke staat, zal de verandering in interne energie tijdens de cyclus gelijk zijn aan nul, d.w.z. ∆u 1-a-2-b-1 = 0. Als resultaat krijgen we, rekening houdend met uitdrukking (1.19), het volgende:
i ts = Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: 1 – Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: 2 (1.20)
Uit (1.20) volgt dat ten eerste de arbeid van de cyclus alleen wordt uitgevoerd als gevolg van warmte en ten tweede dat de arbeid van de cyclus gelijk is aan de door de warmtebron geleverde warmte, minus de warmte die naar het koellichaam wordt afgevoerd.
Het aandeel nuttig gebruikte warmte wordt thermisch geschat k en m
Cyclusefficiëntie, aangegeven met η t.
Onder thermisch rendement wordt verstaan de verhouding van de omgezette warmte
badkamer in het nuttige werk van de cyclus, voor alle geleverde warmte:
η
T
=
 of
η
T
= 1 -
of
η
T
= 1 -
 .
(1.21)
.
(1.21)
Uit deze uitdrukkingen volgt dat hoe minder warmte wordt overgedragen naar de warmteontvanger, hoe groter de waarde van η t.
Dit betekent dat er een vollediger omzetting van warmte in arbeid plaatsvindt.
Vanwege de noodzaak om een deel van de energie in de vorm van warmte naar het koellichaam over te dragen, kan het thermisch rendement van welke cyclus dan ook niet gelijk zijn aan één.
De tweede wet van de thermodynamica stelt dus de volledigheid vast van de omzetting van warmte in arbeid.
Daarnaast wijst hij op het kwalitatieve verschil tussen warmte en arbeid. Als arbeid volledig spoorloos in warmte kan worden omgezet, kan warmte nooit volledig in arbeid worden omgezet. .
Een unieke wetenschappelijke prestatie was de uitdrukking van dit kwalitatieve verschil door een kwantitatieve grootheid: entropie
1.2.3.
“Entropie. Wiskundige uitdrukking van de tweede wet thermodynamica. Entropie ' vertaald uit het Grieks betekent 'draai' of 'transformatie'. Aanvankelijk werd het concept van entropie formeel in de wetenschap geïntroduceerd. R. Clausius (1854) toonde aan dat een thermodynamisch systeem een bepaalde functie heeft
 (1.22)
(1.22)
S
, waarvan de toename wordt bepaald door de uitdrukking
dL verlengd = Hij noemde deze functie entropie. Later, toen een groot aantal problemen werd overwogen, werd de fysieke inhoud van entropie onthuld. Omdat entropie zich niet leent voor een eenvoudige intuïtieve representatie, zullen we proberen de betekenis ervan te verduidelijken door vergelijking met soortgelijke grootheden die voor ons begrip beter toegankelijk zijn. Laten we de uitdrukking voor het expansiewerk in differentiële vorm opschrijven:.
P Hij noemde deze functie entropie. Later, toen een groot aantal problemen werd overwogen, werd de fysieke inhoud van entropie onthuld. dV Er is hier druk is de hoeveelheid nodig, Maar niet genoeg parameter. Het is dus mogelijk om te beoordelen dat het werk van expansie of compressie alleen is gedaan door de verandering in volume.
Laten we nu expressie (1.22) in de vorm schrijven:
dQ = T dS.
Hier is temperatuur de hoeveelheid Er is hier druk maar nog niet voldoende om te praten over de vraag of er warmte aan het systeem wordt toegevoerd of daaruit wordt verwijderd. Bij een adiabatisch proces wisselt het systeem dus geen warmte uit met de omgeving, maar verandert de temperatuur aanzienlijk. Er blijft één parameter over die de eigenschap moet hebben toereikendheid, en deze parameter is entropie. Alleen aan de hand van de verandering in entropie kan men de warmte-uitwisseling tussen het systeem en de omgeving beoordelen. Vanaf hier
Entropie is een calorische parameter van de toestand van een thermodynamische toestand
welk systeem, dat de richting van het proces karakteriseert
warmte-uitwisseling tussen het systeem en de externe omgeving.
We kunnen zeggen dat entropie de enige fysieke grootheid is waarvan de verandering tijdens het proces duidelijk de aanwezigheid van energie-uitwisseling in de vorm van warmte aangeeft.
Uitdrukking (1.22) legt zowel een kwalitatief als een kwantitatief verband vast tussen warmte en entropie: als de entropie van een lichaam of systeem verandert, wordt in beide gevallen energie geleverd in de vorm van warmte; als de entropie onveranderd blijft, verloopt het proces zonder energie-uitwisseling in de vorm van warmte. Gelijkheid (1.22) is een analytische uitdrukking van de tweede wet van de thermodynamica voor een elementair evenwichtsproces.
Uitdrukking (1.22) maakt het mogelijk de eenheid van entropie vast te stellen, die gelijk is aan J/K.
De absolute waarde van entropie wordt bepaald tot een bepaalde constante Entropie 0 . Numerieke waarde van de constante Entropie 0 kan niet alleen worden bepaald op basis van de eerste en tweede wet van de thermodynamica. Dit legt echter geen beperkingen op aan het gebruik van entropie in berekeningen. In de praktijk is het in de regel niet de absolute waarde van de entropie die van belang is, maar de verandering ervan, waarvoor de numerieke waarde van de constante Entropie 0 speelt geen bijzondere rol. Daarom wordt aan een waarde vaak een willekeurige waarde toegekend voor een conventioneel aanvaarde, zogenaamde standaardtoestand van het lichaam. Als deze standaardtoestand als de begintoestand wordt beschouwd en de entropiewaarde eraan wordt toegewezen Entropie 0 , en vervolgens om de entropie in de staat te berekenen A er zal een uitdrukking zijn:

De verminderde entropiewaarde wordt aangegeven met S = Entropie / M met eenheid afmetingen J/(kg×K).
Uitdrukking (1.22), geschreven in termen van de gegeven waarden, zal de vorm hebben:
 .
(1.23)
.
(1.23)
Entropie heeft, als calorische parameter, een aantal eigenschappen.
1. Entropie is een unieke functie van de toestand van het systeem.
2. Entropie is, net als interne energie, een additieve hoeveelheid.
 .
.
3. Voor omkeerbare en onomkeerbare processen in een thermodynamisch systeem
onderwerp wordt de verandering in entropie bepaald door de vergelijking:
 ,
(1.24)
,
(1.24)
waarin het gelijkteken verwijst naar omkeerbare processen, verwijst het groter dan-teken naar onomkeerbare processen.
Uit uitdrukkingen (1.24) volgt dat de entropie van een geïsoleerd systeem onveranderd kan blijven of kan toenemen, maar niet kan afnemen.
1.2.4. Exergie
De introductie van het concept 'entropie' maakt het mogelijk om het kwalitatieve verschil tussen warmte en arbeid te kwantificeren. Voor een systeem dat 1 kg weegt, verkrijgen we vergelijkingen die analytische uitdrukkingen van de eerste en tweede wet van de thermodynamica combineren. Uit uitdrukkingen (1.23) en (1.19) volgt dus:
ds
=
 .
(1.25)
.
(1.25)
Uit gelijkheden (1.23) en (1.18) verkrijgen we:
ds
=
 .
(1.26)
.
(1.26)
Vergelijkingen in de vorm (1.25) en (1.26) worden thermodynamisch genoemd im- i t o d e s t v a m i. Met hun hulp worden een aantal kenmerken van systemen in de thermodynamica vastgelegd en worden de verbanden tussen fysieke grootheden in processen vollediger onthuld.
Met behulp van vergelijking (1.25) stellen we de maximaal mogelijke hoeveelheid technisch werk vast die kan worden uitgevoerd door een bepaald thermodynamisch systeem, dat zich in een bepaalde begintoestand bevindt, als alle door het systeem uitgevoerde processen omkeerbaar zijn en worden uitgevoerd tot in de eindtoestand. evenwicht met de omgeving.
In de thermodynamica wordt de maximaal mogelijke technische arbeid van een systeem ex erg y genoemd .
Geef de exergie van het systeem door E X . De SI-eenheid van exergie is joule. Zijn verminderde waarde (e X = E X / M) heeft een meeteenheid J/kg.
In een gesloten thermodynamisch systeem kan men bij het omzetten van warmte in arbeid volgens de Carnot-cyclus rekening houden met: e X
=
i
ts. Vervolgens wordt warmte verwijderd uit een bron met een temperatuur T 1 in een omgeving met een temperatuur T 0 heeft schrijfrecht e X
=
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa:·  t = Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa:
(1 -
t = Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa:
(1 -
 ). Laten we de omstandigheden bepalen waaronder deze transformaties in andere cycli het maximaal mogelijke werk zullen opleveren.
). Laten we de omstandigheden bepalen waaronder deze transformaties in andere cycli het maximaal mogelijke werk zullen opleveren.
 Laat de begintoestand van het systeem worden gekarakteriseerd door het punt A, Afb. 1.8. Bij interactie met de omgeving neigt de toestand van het systeem naar evenwicht, aangegeven door een punt O. Proces o.a niets meer dan de overgang van het systeem van de initiële naar de evenwichtstoestand. Laten we niet vergeten dat de omgevingstemperatuur, ondanks de interactie met het systeem, constant blijft en gelijk is aan T0.
Laat de begintoestand van het systeem worden gekarakteriseerd door het punt A, Afb. 1.8. Bij interactie met de omgeving neigt de toestand van het systeem naar evenwicht, aangegeven door een punt O. Proces o.a niets meer dan de overgang van het systeem van de initiële naar de evenwichtstoestand. Laten we niet vergeten dat de omgevingstemperatuur, ondanks de interactie met het systeem, constant blijft en gelijk is aan T0.
Met behulp van de vergelijking van de eerste wet van de thermodynamica van de vorm (1.15) en Fig. 1.8
e X = Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: A - en technisch werk vervangen door exergie, krijgen we: +(Q 0 – Q A ). (1.27)
O o.a . Voor het bepalen Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: A - en technisch werk vervangen door exergie, krijgen we: Laten we de tweede wet van de thermodynamica gebruiken. Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: Het is duidelijk dat de hoeveelheid warmte die door de omgeving wordt ontvangen wo Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: o.a, is gelijk aan de hoeveelheid warmte die door het systeem wordt overgedragen aan de omgeving,
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: Het is duidelijk dat de hoeveelheid warmte die door de omgeving wordt ontvangen = - Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: A - en technisch werk vervangen door exergie, krijgen we: (1.28)
, d.w.z. Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: A - en technisch werk vervangen door exergie, krijgen we: De hoeveelheid warmte S en technisch werk vervangen door exergie, krijgen we: - en technisch werk vervangen door exergie, krijgen we:- A- S A evenredig met de oppervlakte onder de procescurve (Fig. 1.8, oppervlakte). T = T en technisch werk vervangen door exergie, krijgen we:). De omgeving neemt warmte waar in een isotherm proces . De begintoestand van dit proces wordt gekenmerkt door het punt . ′ ) O S en technisch werk vervangen door exergie, krijgen we: - en technisch werk vervangen door exergie, krijgen we:- en technisch werk vervangen door exergie, krijgen we: " - S en technisch werk vervangen door exergie, krijgen we: / , en de laatste (punt S en technisch werk vervangen door exergie, krijgen we: - en technisch werk vervangen door exergie, krijgen we:- A- S A .
moet zodanig zijn dat pl.
Met behulp van uitdrukkingen (1.9) en (1.11) schrijven we de resulterende vergelijkingen in differentiële vorm: Het is duidelijk dat de hoeveelheid warmte die door de omgeving wordt ontvangen = T en technisch werk vervangen door exergie, krijgen we: ds Het is duidelijk dat de hoeveelheid warmte die door de omgeving wordt ontvangen ,
, volgens (1.28), was gelijk aan pl. . Sinds volgens de tweede wet van de thermodynamica A dan na het integreren van deze uitdrukking van de staat
Tot nu toe zijn systemen van willekeurige massa overwogen. Voor analyse is het handiger om waarden te gebruiken die zijn teruggebracht tot een eenheidsmassa van een stof. Laten we vergelijkingen (1.13) en (1.14) schrijven voor 1 kg massa: ter zake zal hebben: 0 cp 0" = T A (S 0 cp A -S 0 ) = T 0 cp 0 ′ -S A ). (1.29)
) + T
e X = (Q A – Q en technisch werk vervangen door exergie, krijgen we: ) – T en technisch werk vervangen door exergie, krijgen we: (S A – S en technisch werk vervangen door exergie, krijgen we: ) – T en technisch werk vervangen door exergie, krijgen we: (S en technisch werk vervangen door exergie, krijgen we: / - S A). (1.30)
-S
Vervolgens wordt, rekening houdend met (1.28), uitdrukking (1.27) geschreven: T 0 (S 0/ - S A ) ≥ 0.
Uit vergelijking (1.30) volgt een aantal belangrijke conclusies: S A 1. In een systeem met omkeerbare processen is de exergie groter dan in hetzelfde systeem met onomkeerbare processen, omdat (Q A – Q 0 2. Hoe groter de waarde van de initiële entropie van het systeem
, hoe minder werk het kan doen met een constant enthalpieverschil
).
Bijgevolg karakteriseert entropie de energie van het systeem.
– de voorwaarden definieert die nodig zijn voor de wederzijdse transformatie van vormen van energie-uitwisseling als warmte en arbeid; – stelt de volledigheid vast van de omzetting van warmte in arbeid. 1.2.5 Het concept van de derde wet van de thermodynamica Bij het bestuderen van de eigenschappen van verschillende stoffen bij lage temperaturen dichtbij het absolute nulpunt
(T = 0), wordt een belangrijk patroon onthuld in het gedrag van echte lichamen:.
in het gebied van het absolute nulpunt is de entropie van een lichaam in welke evenwichtstoestand dan ook niet afhankelijk van temperatuur, volume en andere parameters die de toestand van het lichaam kenmerken.
Dit resultaat, dat een generalisatie is van een aantal experimentele gegevens en niet rechtstreeks voortvloeit uit de eerste of tweede wet van de thermodynamica, vormt de inhoud
De thermische stelling van Nernst
Bij het absolute nulpunt gaat de entropie van alle stoffen in een evenwichtstoestand, ongeacht druk, dichtheid en fase, naar nul.
De analytische uitdrukking van de derde wet van de thermodynamica is gelijkheid (1.31).
Tweede wet van de thermodynamica. Entropie.
De tweede wet houdt verband met het concept van entropie, dat een maatstaf is voor chaos (of een maatstaf voor orde). De tweede wet van de thermodynamica stelt dat voor het universum als geheel de entropie toeneemt.
Er zijn twee klassieke definities van de tweede wet van de thermodynamica:
Kelvin en Planck
- Clausius
Er bestaat geen cyclisch proces dat bij een bepaalde temperatuur een hoeveelheid warmte uit een reservoir haalt en die warmte volledig omzet in arbeid. (Het is onmogelijk om een periodiek werkende machine te bouwen die niets anders doet dan een last optillen en een warmtereservoir koelen)
Er bestaat geen proces waarvan het enige resultaat de overdracht van warmte is van een minder verwarmd lichaam naar een meer verwarmd lichaam. (Een circulair proces is onmogelijk, waarvan het enige resultaat de productie van werk zou zijn door het koelen van het warmtereservoir)
Beide definities van de tweede wet van de thermodynamica zijn gebaseerd op de eerste wet van de thermodynamica, die stelt dat energie afneemt.
De tweede wet houdt verband met het concept entropie (S).
Entropie. Wiskundige uitdrukking van de tweede wet gegenereerd door alle processen, wordt het geassocieerd met het verlies van het vermogen van het systeem om werk te doen. De groei van entropie is een spontaan proces. Als het volume en de energie van een systeem constant zijn, verhoogt elke verandering in het systeem de entropie. Als het volume of de energie van het systeem verandert, neemt de entropie van het systeem af. De entropie van het heelal neemt echter niet af.
Om energie te kunnen gebruiken, moeten er gebieden met een hoog en een laag energieniveau in het systeem zijn. Nuttig werk wordt geproduceerd door de overdracht van energie van een gebied met een hoog energieniveau naar een gebied met een laag energieniveau.
- 100% van de energie kan niet in arbeid worden omgezet
- Entropie kan worden gegenereerd, maar kan niet worden vernietigd
Efficiëntie van de warmtemotor
De efficiëntie van een warmtemotor die tussen twee energieniveaus werkt, wordt bepaald in termen van absolute temperaturen
η = (T h - T c) / T h = 1 - T c / T h
η = efficiëntie
T c = onderste temperatuurgrens (K)
Om een maximale efficiëntie te bereiken, moet Tc zo laag mogelijk worden gehouden. Om het effect 100% te laten zijn, moet T c gelijk zijn aan 0 op de schaal van Kelvin. In de praktijk is dit onmogelijk, dus het rendement is altijd kleiner dan 1 (minder dan 100%).
- Entropieverandering > 0
Onomkeerbaar proces - Entropieverandering= 0
Bilateraal proces (omkeerbaar) - Entropie verandering< 0
Onmogelijk proces (niet haalbaar)
Entropie bepaalt het relatieve vermogen van het ene systeem om het andere te beïnvloeden. Naarmate energie naar een lager energieniveau beweegt, waar het potentieel voor impact op het milieu afneemt, neemt de entropie toe.
Definitie van entropie
Entropie wordt gedefinieerd als:
T = absolute temperatuur (K)
Een verandering in de entropie van een systeem wordt veroorzaakt door een verandering in de temperatuurinhoud ervan. De verandering in entropie is gelijk aan de verandering in de temperatuur van het systeem gedeeld door de gemiddelde absolute temperatuur (Ta):
Som van waarden (H/T) voor elk volle cirkel Carnot is 0. Dit komt omdat er voor elke positieve H een tegengestelde negatieve H-waarde is.
- Carnot thermische cyclus
De Carnot-cyclus is een ideale thermodynamische cyclus.
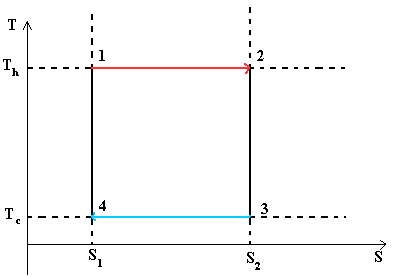
IN warmte motor wordt het gas (omkeerbaar) verwarmd en vervolgens afgekoeld. Het cyclusmodel is als volgt: Positie 1 --() --> Positie 2 --() --> Positie 3 --(isotherme compressie) --> Positie 4 --(adiabatische compressie) --> Positie 1
Positie 1 - Positie 2: Isothermische expansie
Isotherme expansie. Aan het begin van het proces heeft de werkvloeistof een temperatuur Th, dat wil zeggen de temperatuur van de verwarmer. Het lichaam wordt vervolgens in contact gebracht met een verwarming, die isotherm (bij een constante temperatuur) een hoeveelheid warmte QH daaraan overdraagt. Tegelijkertijd neemt het volume van de werkvloeistof toe. Q H =∫Tds=T h (S 2 -S 1) =T h ΔS
Positie 2 - Positie 3: Adiabatische expansie
Adiabatische (isentropische) expansie. De werkvloeistof wordt losgekoppeld van de verwarmer en blijft uitzetten zonder warmte-uitwisseling met de omgeving. Tegelijkertijd daalt de temperatuur tot de temperatuur van de koelkast.
Positie 3 - Positie 4: Isothermische compressie
Isotherme compressie. De werkvloeistof, die tegen die tijd een temperatuur Tc heeft, wordt in contact gebracht met de koelkast en begint isotherm te comprimeren, waardoor de hoeveelheid warmte Qc aan de koelkast wordt afgegeven. Qc =Tc (S2-S1)=Tc ΔS
Positie 4 - Positie 1: Adiabatische compressie
Adiabatische (isentropische) compressie. De werkvloeistof wordt losgekoppeld van de koelkast en gecomprimeerd zonder warmte-uitwisseling met de omgeving. Tegelijkertijd stijgt de temperatuur tot de temperatuur van de verwarming.
Tijdens isotherme processen blijft de temperatuur constant; tijdens adiabatische processen is er geen warmte-uitwisseling, waardoor de entropie behouden blijft.
Daarom is het handig om de Carnot-cyclus weer te geven in T- en S-coördinaten (temperatuur en entropie).
De wetten van de thermodynamica werden empirisch (experimenteel) bepaald. De tweede wet van de thermodynamica is een generalisatie van experimenten die verband houden met entropie. Het is bekend dat dS van het systeem plus dS van de omgeving gelijk is aan of groter is dan 0.
- De entropie van een adiabatisch geïsoleerd systeem verandert niet!
Voorbeeld - Entropie bij het verwarmen van water
Het proces waarbij 1 kg water wordt verwarmd 0 tot 100 o C (273 tot 373 K)
Bij 0 o C = 0 kJ/kg (specifiek - per massa-eenheid)
Bij 100 o C = 419 kJ/kg
Verandering in specifieke entropie:
dS = dH / T a
= ((419 kJ/kg) - (0 kJ/kg)) / ((273 K + 373 K)/2)
= 1.297 kJ/kg*K
Voorbeeld - Entropie tijdens verdamping van water
Het proces waarbij 1 kg water van 100 o C (373 K) onder normale omstandigheden wordt omgezet in verzadigde stoom van 100 o C (373 K).
Specifieke stoomenthalpie bij 100 o C (373 K) voor verdamping = 0 kJ/kg
100 o C (373 K) bij verdamping = 2.258 kJ/kg
Verandering in specifieke entropie:
dS = dH / T a
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 kJ/kg*K
De totale verandering in de specifieke entropie van waterverdamping is de som van de specifieke entropie van water (bij 0 o C) plus de specifieke entropie van stoom (bij een temperatuur van 100 o C).