Uit de studie van verschillende stoffen bleek. Deeltjes interageren met elkaar
Interactie van materiedeeltjes
De moderne theorie van de structuur van materie is gebaseerd op vijf hoofdbepalingen.
1. Alle stoffen zijn opgebouwd uit deeltjes.
Atoom – kleinste deeltje chemisch element dat zijn eigenschappen behoudt. allemaal bekend chemische elementen vermeld in het periodiek systeem. Een molecuul is het kleinste deeltje van een stof dat zijn eigenschappen behoudt. Een molecuul kan uit een of meer atomen bestaan.
2. Er zijn openingen tussen de materiedeeltjes.
3. Materiedeeltjes bewegen continu en willekeurig.
4. De beweging van materiedeeltjes wordt intenser naarmate de temperatuur stijgt. De beweging van materiedeeltjes wordt thermisch genoemd.
5. Materiedeeltjes interageren met elkaar: ze trekken aan en stoten af. Aantrekking en afstoting werken gelijktijdig en constant. Interactiekrachten bepalen de eigenschappen van geaggregeerde toestanden van materie. Aangezien de samenstelling van atomen en moleculen deeltjes met elektrische lading omvat, zijn intermoleculaire interacties van elektromagnetische aard. De aantrekkingskracht en afstoting zijn verschillend afhankelijk van de afstand tussen de deeltjes. Op een afstand die ongeveer gelijk is aan de deeltjesgrootte, zijn aantrekking en afstoting gelijk. Deze afstand komt overeen met de meest stabiele rangschikking van deeltjes; naarmate de afstand kleiner wordt, overheerst de afstoting van deeltjes. Met verhoging - attractie. Bij afstanden die tien keer of meer groter zijn dan de deeltjesgrootte, zijn de interactiekrachten verwaarloosbaar.
Elk van de vijf bepalingen van de theorie van de structuur van materie heeft experimenteel bewijs.
1. Hoge vergrotingsfoto's van stoffen. Verschijnselen zoals malen, oplossen, verspreiden van vloeistoffen tot de vorming van dunne films.
2. Foto's van de stof. thermische expansie stoffen. Vermindering van het totale volume bij het mengen van verschillende vloeistoffen.
3. Diffusie en Brownse beweging.
4. Een toename van de diffusiesnelheid en intensiteit van de Brownse beweging met een toename van de temperatuur van de stof.
5. Aan elkaar plakken van stoffen wanneer ze in nauw contact zijn, elastische vervormingen, vloeibare bevochtiging van vaste oppervlakken.
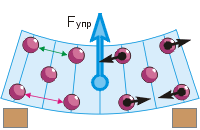
In de figuur rechts zijn de deeltjes van het lichaam schematisch weergegeven als geordende ballen. De pijlen tonen de afstotende krachten die vanuit zijn "buren" op het deeltje inwerken. Als alle deeltjes zich op gelijke afstand van elkaar zouden bevinden, zouden de afstotende krachten onderling in evenwicht zijn ("groen" deeltje).
Volgens de tweede positie van de MKT zijn de deeltjes echter constant en willekeurig in beweging. Hierdoor veranderen de afstanden van elk deeltje tot zijn buren voortdurend (het "rode" deeltje). Bijgevolg veranderen de krachten van hun interactie voortdurend en zijn ze niet in evenwicht, in een poging het deeltje terug te brengen naar de evenwichtspositie. Dat is, potentiële energie van vaste deeltjes en vloeibare lichamen, altijd bestaand, voortdurend in verandering. Vergelijk: in gassen is de potentiële energie van deeltjes praktisch afwezig, omdat ze ver van elkaar verwijderd zijn (zie § 7-b).
De opkomst van elastische kracht. Door het lichaam samen te drukken of uit te rekken, te buigen of te draaien, brengen we de deeltjes samen of verwijderen we deze (zie figuur). Daarom veranderen de krachten van aantrekking en afstoting van deeltjes, waarvan de gezamenlijke actie is elasticiteit kracht.
De rubberen deeltjes van een buigbare gum (zie ook Fig. "d") hebben we conventioneel afgebeeld als ballen. Wanneer ze met een vinger worden ingedrukt, naderen de bovenste deeltjes elkaar (“groene” afstand is kleiner dan “rood”). Dit leidt tot het optreden van afstotende krachten (zwarte pijlen zijn van de deeltjes af gericht). Bij de onderrand van de gum bewegen de deeltjes van elkaar weg, wat leidt tot het verschijnen van aantrekkingskrachten ertussen (zwarte pijlen zijn naar de deeltjes gericht). Als gevolg van de gelijktijdige werking van afstotende krachten nabij het bovenvlak en aantrekkingskrachten nabij het ondervlak, "wil" de gum zich rechtzetten. En dit betekent dat er een elastische kracht in ontstaat, die tegengesteld is aan de drukkracht.
Test je kennis:
- Het belangrijkste doel van deze sectie is het bespreken van...
- Wat zullen we opmerken bij het samendrukken van de uiteinden van de cilinders?
- Zijn de cilinders stevig aan elkaar bevestigd?
- Welke conclusie volgt uit het experiment met cilinders?
- Onder welke voorwaarde ontstaat de aantrekkingskracht van deeltjes van lichamen en stoffen?
- Welke waarneming getuigt van de afstoting van deeltjes?
- Waarom denken we dat materiedeeltjes elkaar kunnen afstoten?
- Onder welke omstandigheden wordt de interactie van deeltjes waargenomen?
- Hoe verandert de aard van de interactie van materiedeeltjes afhankelijk van de afstand ertussen?
- In welk geval is de interactie van deeltjes van stoffen afwezig?
- Waarom hebben materiedeeltjes potentiële energie?
- Waarom hebben deeltjes van vaste en vloeibare stoffen altijd potentiële energie?
- Wat symboliseren de zwarte pijlen in de figuur met deeltjes van een vaste stof?
- Omdat de deeltjes van elk lichaam of elke substantie constant in beweging zijn, ...
- Omdat de afstanden tussen deeltjes voortdurend veranderen, ...
- Karakteriseren van de potentiële energie van deeltjes van vaste stoffen en vloeistoffen. Ze, ...
- Karakteriseren van de potentiële energie van gasdeeltjes.
- In welke gevallen veranderen we de afstand tussen de deeltjes van het lichaam?
- Tegelijkertijd veranderen de krachten van aantrekking en afstoting van de deeltjes van het lichaam, aangezien ...
- De elastische kracht van een lichaam is de gelijktijdig werkende ...
- Wat gebeurt er met de deeltjes aan de bovenkant van de gum? Zij...
- De elastische kracht in de gum is te wijten aan...
Je weet dat deeltjes in lichamen constant in willekeurige beweging zijn. Waarom valt een vast lichaam niet uiteen in afzonderlijke deeltjes? Dit komt omdat de deeltjes (moleculen of atomen) van de meeste vaste stoffen in een bepaalde volgorde en heel dicht bij elkaar gerangschikt.
Elk deeltje trekt naburige deeltjes naar zich toe en wordt er zelf door aangetrokken. Deze krachten houden bijvoorbeeld ijzeratomen vast in een stuk metaal, watermoleculen in een stuk ijs of in een druppel water. Met andere woorden, aantrekkingskracht is de kracht die deeltjes bij elkaar houdt.
Als je de breinaald in twee delen breekt en ze samenvoegt, worden ze niet bij elkaar gehouden. Het blijkt dat aantrekking tussen de materiedeeltjes alleen mogelijk wordt als ze zich op een bepaalde afstand, dicht genoeg bij elkaar bevinden.
Ervaring maakt het mogelijk om de aantrekkingskracht van deeltjes te detecteren.
Ze nemen een kleine loden cilinder, snijden deze in twee helften en verplaatsen ze snel met verse sneden. Als de snede geen tijd heeft gehad om te oxideren, zullen beide delen van de loden cilinder tot één samenvloeien. Dit kan worden gecontroleerd door een van de cilinders in de houder te bevestigen en aan de andere een last te hangen. De helft van de cilinder met de lading valt niet. Dientengevolge werken de moleculen van de helften van de cilinder met elkaar in wisselwerking.
Rijst. 34. Aantrekkingskracht van deeltjes. De twee helften van de loden cilinder zijn verbonden door de interactie van moleculen.
Het beschreven experiment slaagt dankzij de zachtheid van lood. Met lichamen die harder zijn dan lood (bijvoorbeeld helften) gebroken glas) is het onmogelijk om een dergelijk experiment uit te voeren.
Om een binding tot stand te brengen, moeten de moleculen zich op een afstand van enkele bevinden kleinere maten de moleculen zelf. stukken zachte stof, zoals plasticine, gemakkelijk aan elkaar plakken. Dit komt omdat ze dichtbij een afstand kunnen worden gebracht waarop de aantrekkingskrachten werken.
De structuur van vloeistoffen is anders dan de structuur van vaste stoffen. In vloeistoffen is de interactie tussen moleculen zwakker dan in vaste stoffen, maar ze bestaat nog steeds. Stel je voor dat water in een glas wordt gegoten en vervolgens in een fles wordt gegoten. Aanvankelijk nam de vloeistof de vorm aan van een glas en vervolgens een fles waarin het werd gegoten. Als er in water een aantrekkingskracht tussen de moleculen was met dezelfde kracht als in vaste stoffen, dan zou de vorm niet zo gemakkelijk kunnen veranderen.
Moleculen in vloeistoffen bevinden zich bijna dicht bij elkaar, dus alle vloeistoffen hebben zeer weinig samendrukbaarheid. Maar de interactie tussen moleculen is niet sterk genoeg om vloeistoffen hun vorm te laten behouden. Dit verklaart de belangrijkste eigenschap van vloeistoffen - vloeibaarheid.
We hebben al gezegd dat gas kan worden gecomprimeerd, zodat het volume ervan meerdere keren afneemt. Dit betekent dat in gassen de afstand tussen moleculen veel groter is dan de grootte van de moleculen zelf. In dergelijke gevallen worden de moleculen zwak tot elkaar aangetrokken. Dit is de reden waarom gassen hun vorm en volume niet behouden.
Er is wederzijdse aantrekkingskracht tussen deeltjes in vaste stoffen, vloeistoffen en gassen.
De vraag rijst: "Waarom zijn er openingen tussen deeltjes?" Het lijkt erop dat de deeltjes, die door elkaar worden aangetrokken, "aan elkaar moeten plakken". Het samendrukken van lichamen wordt echter voorkomen deeltjes afstoting. Dat dit zo is, blijkt uit een voorbeeld. Een rubberen gum die wordt samengedrukt en dubbelgevouwen, wordt rechtgetrokken wanneer de randen worden losgelaten. Gecomprimeerde lichamen worden recht, omdat de deeltjes, wanneer ze worden samengedrukt, zo dicht bij elkaar liggen dat ze elkaar beginnen af te stoten. Vandaar, aantrekkingskracht tussen deeltjes – atomen en moleculen, houdt ze dicht bij elkaar, en afstoting verhindert hun volledige convergentie.
Sectie 2. Grondbeginselen van moleculair-kinetische theorie.
2.1 Basisbepalingen van de moleculair-kinetische theorie. Brownse beweging. Krachten en energie van intermoleculaire interactie. Afmetingen en massa van moleculen. Avogadro-constante. Ideaal gas. Gas druk. Interstellair gas*.
De belangrijkste bepalingen van de moleculair-kinetische theorie en hun experimentele onderbouwing.
Ontwikkeling van ideeën over de structuur van materie. De veronderstelling dat elke stof bestaat uit de kleinste ondeelbare deeltjes - atomen, werd ongeveer 2500 jaar geleden gemaakt door de oude Griekse filosofen Leucippus en Democritus. Volgens hen worden alle lichamen gevormd door de combinatie van atomen. Verschillen in eigenschappen van lichamen worden verklaard doordat lichamen uit verschillende atomen bestaan of identieke atomen op verschillende manieren in de ruimte met elkaar verbonden zijn.
Een belangrijke bijdrage aan de ontwikkeling van moleculaire kinetische concepten werd geleverd in het midden van de 18e eeuw. de grote Russische wetenschapper Mikhail Vasilyevich Lomonosov (1711-1765). Hij verklaarde de basiseigenschappen van een gas door aan te nemen dat alle gasmoleculen willekeurig, chaotisch bewegen en elkaar afstoten wanneer ze botsen. M. V. Lomonosov was de eerste die de aard van warmte verklaarde door de willekeurige beweging van moleculen. Omdat de thermische bewegingssnelheden van moleculen willekeurig groot kunnen zijn, heeft de temperatuur van een stof volgens zijn ideeën geen bovengrens. Wanneer de snelheid van moleculen tot nul daalt, moet de minimaal mogelijke waarde van de temperatuur van de stof worden bereikt.
Basisbepalingen van de moleculair-kinetische theorie. macroscopische lichamen worden grote lichamen genoemd, bestaande uit enorm aantal moleculen. (Gas in een fles, water in een glas, een zandkorrel, een wereldbol).
thermische verschijnselen noem de verschijnselen die verband houden met het opwarmen en afkoelen van lichamen, met een verandering in hun temperatuur.
thermische beweging– het is de willekeurige beweging van moleculen.
Moleculaire kinetische theorie noemde de doctrine van de structuur en eigenschappen van materie, met behulp van het idee van het bestaan van atomen en moleculen als de kleinste deeltjes van een chemische stof.
De belangrijkste bepalingen van de moleculair-kinetische theorie van de structuur van materie:
* de stof bestaat uit deeltjes - atomen en moleculen;
*deze deeltjes bewegen willekeurig;
deeltjes interageren met elkaar.
Brownse beweging– is thermische beweging gewogen in een vloeistof (of gas) van deeltjes en het kan niet stoppen, omdat gerelateerd aan lichaamstemperatuur. Voor het eerst werd dit fenomeen waargenomen door de Engelse botanicus Robert Brown in 1927, waarbij hij de sporen van het clubmos in water onder een microscoop onderzocht. Brownse beweging stopt nooit, omdat het is thermische beweging. Naarmate de temperatuur stijgt, neemt de intensiteit toe.
Een voorbeeld van Brownse beweging in gassen is de beweging van stof- en rookdeeltjes in de lucht. De reden voor de Brownse beweging van een deeltje is dat de inslagen van de vloeibare moleculen op het deeltje elkaar niet compenseren. (Figuur 4.1)
Diffusie– dit is het mengen van moleculen van gassen, vloeistoffen en vaste stoffen in direct contact, d.w.z. de penetratie van moleculen van de ene stof in de intermoleculaire ruimte van een andere. De diffusiesnelheid is afhankelijk van de temperatuur en de toestand van de stof. Dit fenomeen wordt verklaard door de willekeurige beweging van moleculen.
Afmetingen en massa van moleculen.
Atoom grootte. Als je je vingers balt tot een vuist en deze vergroot tot de maat de wereldbol, dan wordt het atoom met dezelfde vergroting zo groot als een vuist.
Aantal moleculen. Met zeer kleine moleculen is het aantal ervan in elk macroscopisch lichaam enorm. Bij elke inademing vangen we zoveel moleculen op dat als ze allemaal gelijk verdeeld waren in de atmosfeer van de aarde na uitademing, elke bewoner van de planeet twee of drie moleculen zou ontvangen die tijdens het inademen in je longen waren geweest.
Relatieve moleculaire (of atomaire) massa van een stof M r is de verhouding van de massa van een molecuul (of atoom) m 0 van een bepaalde stof tot de massa van een koolstofatoom m 0 c: 
Hoeveelheid substantie(ν) –
is gelijk aan de verhouding van het aantal moleculen N in een bepaald lichaam tot de constante van Avogadro NA (of de verhouding van de massa van een stof tot zijn molaire massa). 

een mol Dit is de hoeveelheid van een stof die evenveel moleculen of atomen bevat als er atomen zijn in 0,012 kg koolstof.
Avogadro-constante.
Avogadro-constante gelijk aan het aantal moleculen in 1 mol van de stof. ;
Molaire massa van stof (M) de massa van een stof genoemd in de hoeveelheid van één mol.
 ;
;  ; M \u003d m / ν, waarbij m de massa van de stof is, ν de hoeveelheid van de stof is
; M \u003d m / ν, waarbij m de massa van de stof is, ν de hoeveelheid van de stof is
Ideaal gas.Ideaal gas– het is een gas, waarvan de interactie tussen de moleculen verwaarloosbaar is. De moleculen van dit gas zijn kleine balletjes die een verwaarloosbaar volume hebben in vergelijking met het volume van het vat. Een ideaal gas is een fysiek model van een echt gas. Ontladen gassen gedragen zich als een ideaal gas.
Gas druk. Laat het gas in een gesloten vat zitten. Er zijn veel gasmoleculen en hun inslagen tegen de muur volgen elkaar met een zeer hoge frequentie op. Gemeen geometrische som krachten die op de kant van individuele moleculen werken bij hun botsingen met de wand van het vat, en is de drukkracht van het gas. De druk zal groter zijn, hoe meer moleculen in een bepaalde tijd de muur raken en hoe groter de snelheid van de moleculen die tegen de muur botsen.
interstellair gas is een ijl gasvormig medium dat alle ruimte tussen sterren vult. Interstellair gas is transparant. De totale massa van interstellair gas in de Melkweg overschrijdt 10 miljard zonsmassa's, of een paar procent van de totale massa van alle sterren in onze Melkweg. De gemiddelde concentratie van atomen in interstellair gas is minder dan 1 atoom per cm³. Zijn hoofdmassa bevindt zich nabij het vlak van de Melkweg in een laag van enkele honderden parsecs dik. De gemiddelde gasdichtheid is ongeveer 10−21 kg/m³. Chemische samenstelling ongeveer hetzelfde als dat van de meeste sterren: het bestaat uit waterstof en helium (respectievelijk 90% en 10% van het aantal atomen) met een kleine toevoeging van zwaardere elementen. Afhankelijk van temperatuur en dichtheid bevindt interstellair gas zich in moleculaire, atomaire of geïoniseerde toestand. Er worden koude moleculaire wolken, ijl gas tussen wolken, wolken van geïoniseerde waterstof met een temperatuur van ongeveer 10 duizend K. (Orionnevel) en uitgestrekte gebieden van ijl en zeer heet gas met een temperatuur van ongeveer een miljoen K waargenomen. zichtbare lichtstralen, worden geabsorbeerd gas en geven het hun energie. Dankzij dit, de hete sterren van hun ultraviolette straling ze verwarmen het omringende gas tot een temperatuur van ongeveer 10.000 K. Het verwarmde gas begint zelf licht uit te zenden, en we nemen het waar als een heldere gasnevel. Het koudere, "onzichtbare" gas wordt waargenomen door radioastronomische methoden. Waterstofatomen in een ijl medium zenden radiogolven uit met een golflengte van ongeveer 21 cm Daarom verspreiden radiogolven zich continu vanuit gebieden van interstellair gas. Door deze straling te ontvangen en te analyseren, leren wetenschappers over de dichtheid, temperatuur en beweging van interstellair gas in de ruimte.
07-g. Interactie van deeltjes van stoffen
In de twee voorgaande paragrafen hebben we experimenten besproken die de eerste en tweede stelling van de MKT illustreren. Laten we nu eens kijken naar experimenten die de derde basispropositie van de MKT en de gevolgen ervan illustreren.
Voor het experiment nemen we twee loden cilinders met haken. Om stofdeeltjes te verwijderen, maken we de uiteinden van beide cilinders glanzend schoon met een mes of mes (afb. a). Door de uiteinden stevig tegen elkaar aan te drukken, zullen we merken dat de cilinders stevig "vastgeklikt" worden. De sterkte van hun hechting is zo groot dat, als het experiment met succes wordt uitgevoerd, de cilinders bestand zijn tegen het gewicht van een gewicht tot 5 kg (Fig. b). Uit deze ervaring volgt de conclusie: materiedeeltjes worden door elkaar aangetrokken. Deze aantrekkingskracht is echter alleen merkbaar wanneer de oppervlakken van de lichamen erg glad zijn en bovendien strak op elkaar aansluiten.

Laten we het tweede experiment doen (Fig. c, d). Het kost veel kracht om met je vinger in een rubberen gum te knijpen; De gum is gemakkelijker te buigen dan te knijpen. Andere lichamen (behalve gasvormig) zijn ook erg moeilijk te persen. Dit suggereert dat materiedeeltjes stoten elkaar af.
Aantrekking en afstoting van deeltjes van stoffen treden alleen op als de deeltjes zich dicht bij elkaar bevinden. Gebruikelijk, op afstanden die groter zijn dan de grootte van de deeltjes zelf, worden ze aangetrokken; op afstanden kleiner dan de deeltjesgrootte stoten ze elkaar af. Als de deeltjes worden verwijderd op een afstand die vele malen groter is dan hun grootte, verschijnt de interactie bijna niet.
Laten we nu eens kijken naar het energieaspect van deeltjesinteractie.

Als er lichamen op elkaar inwerken, hebben ze: potentiële energie afhankelijk van de onderlinge positie van deze instanties (zie § 5-e). In de figuur hiernaast tonen de pijlen op de deeltjes de afstotende krachten van de "buren". Hetzelfde kan gezegd worden over de aantrekkingskrachten. Als alle deeltjes op gelijke afstand van elkaar zouden zijn, dan zouden alle krachten onderling in evenwicht zijn ("groen" deeltje). Volgens de tweede positie van de MKT bewegen de deeltjes echter. Daarom veranderen de afstanden van elk deeltje tot zijn buren voortdurend (het "rode" deeltje). Bijgevolg veranderen de krachten van hun interactie voortdurend en zijn ze niet in evenwicht. Met deze veranderingen in afstanden en krachten de potentiële energie van elk deeltje verandert en neemt de minimumwaarde in de positie van zijn evenwicht.
De potentiële energie van een deeltje wordt als nul beschouwd wanneer het zich op grote afstand van andere deeltjes bevindt, zoals bijvoorbeeld in gassen, waar er praktisch geen interactie is tussen deeltjes (zie Fig. § 7-b). In vaste en vloeibare stoffen is de interactie van deeltjes, wat betekent dat er ook de potentiële energie van deeltjes is (we merken tussen haakjes op: het is negatief, maar nu is de waarde ervan in absolute waarde voor ons belangrijk). En om de interactie van deeltjes te overwinnen en ze op afstand te scheiden, moet je werken. En hoe meer werk om de interactie van deeltjes te overwinnen om ze op afstand te scheiden, hoe groter (in modulus) de potentiële energie van interactie tussen de deeltjes van de stof die wordt bestudeerd.
De opkomst van elastische kracht. Door het lichaam samen te drukken of uit te rekken, te buigen of te draaien, brengen we de deeltjes samen of verwijderen we deze (zie figuur). Dus de krachten van aantrekking en afstoting van deeltjes veranderen, waarvan de gezamenlijke werking zich manifesteert als een elastische kracht.
Laten we terugkeren naar de bocht van de gum (fig. d). We hebben rubberdeeltjes voorwaardelijk afgebeeld als ballen. Wanneer ze met een vinger worden ingedrukt, naderen de bovenste deeltjes elkaar (“groene” afstand is kleiner dan “rood”). Dit leidt tot de opkomst tussen hen afstotende krachten(zwarte pijlen wijzen weg van de deeltjes). De onderste deeltjes bewegen van elkaar weg, wat leidt tot het uiterlijk ertussen aantrekkingskrachten(zwarte pijlen zijn gericht op de deeltjes). Als gevolg hiervan heeft de gum de neiging om rechtop te gaan staan, wat betekent dat er een opwaartse elastische kracht in zit - tegengesteld aan de vingerdrukkracht.
Javascript is uitgeschakeld in uw browser.ActiveX-besturingselementen moeten zijn ingeschakeld om berekeningen te kunnen maken!